
UPTD PENDIDIKAN SMK NEGERI 1 PURWOSARI PASURUAN
(SEKOLAH BERTARAF INTERNASIONAL )
MODUL FISIKA KELAS XI
SEMESTER GASAL

OLEH : NOVI INDIYASARI, S.Pd

SUHU
I. Standar Kompetensi
8. Menerapkan konsep suhu dan kalor
II. Kompetensi Dasar
8.1 Memahami konsep suhu dan kalor
III. Indikator
1. Mengidentifikasi sifat termometrik bahan
2. Mengiidentifikasi macam-macam skala-skala termometer
3. Menggunakan Termometer untuk mengukur suhu berbagai benda
IV. Materi pelajaran
1. Pengertian Suhu dan kalor
2. Penentuan skala suhu dan termometer
3. Jenis-jenis skala suhu
4. Jenis-jenis skala termometer

1.1 Pengertian suhu
Kalian tentunya pernah mandi menggunakan air hangat bukan? Untuk mendapatkan air hangat tersebut kita mencampurnya dahulu air dingin dengan air panas sehingga diperoleh air hangat. Ketika tangan kita menyentuh air yang dingin, maka kita mengatakan suhu air tersebut dingin. Ketika tangan kita menyentuh air yang pana maka kita katakana suhu air tersebut panas. Untuk menyatakan ukuran derajad panas dan dinginnya suatu benda tersebut dinyatakan dengan besaran suhu. Jadi suhu adalah suatu besaran untuk menyatakan ukuran derajad panas atau dinginnya suatu benda.
1.1.1 Termometer sebagai alat ukur Suhu
Suhu termasuk besaran pokok. Alat untuk untuk mengukur besarnya suhu suatu benda adalah temometer. Termometer yang umum digunakan adalah thermometer zat cair. Zat cair yang digunakan sebagai pengisi pipa kapiler biasanya adalah raksa atau alcohol. Pertimbangan dipilihnya raksa sebagai pengisi pipa kapiler untuk membuat termomyter adalah;
- Raksa tidak membasahi dinding kaca
- Raksa merupakan penghantar panas yang baik
- Kalor jenis raksa rendah akibatnya dengan perubahan panas yang kecil cukup dapat mengubah suhunya
- Jangkauan ukur raksa lebar karena titik bekunya – 390C dan titik didihnya 3570C.
Untuk mengukur suhu yang sangat rendah biasanya digunakan Termometer alkohol . Alkohol memiliki titik beku yang sangat rendah, yaitu titik beku alcohol -1140C. Namun demikian thermometer alcohol tidak dapat digunakan untuk mengukur suhu benda yang tinggi sebab titik didihnya 780C.
Untuk membuat thermometer, maka terlebih dahulu ditetapkan titik tetap atas dan titik tetap bawah. Tirtik tetap thermometer tersebut diukur pada tekanan 1 atmosfer. Diantara kedua titik tetap tersebut dibuat skala suhu termometer. Penetapan titik tetap bawah adalah suhu ketika es melebur dan penetapan titik tetap atas adalah suhu saat air mendidih. Berikut ini adalah penetapan titik tetap pada skala thermometer, yaitu :
- Termometer Celcius
Titik tetap bawahya diberi angka 0 dan titik tetap atasnya diberi angka 100. Diantara titik tetap bawah dan titik tetap atas dibagi 100 skala.
- Termometer Reamur
Titik tetap bawahnya diberi angka 0 dan titik tetap atasnya diberi angka 80. Diantara titik tetap bawah dan titik tetap atas dibagi bagi 80 skala.
- Temometer Fahrenheit
Titik tetap bawahnya diberi angka 32 dan titik tetap atasnya diberi angka 212. Suhu es yang dicampur dengan garam ditetapkan 00F. Diantara titik tetap bawah dan titik tetap atas dibagi 180 skala.
- Termometer Kelvin
Pada thermometer Kelvin, titik terbawah diberi angka nol. Titik ini disebut suhu mutlak, yaitu suhu terkecil yang dimiliki benda ketika energi total partikel benda tersebut nol.. Kelvin menetapkan suhu es melebur dengan angka 273 dan suhu air mendidih dengan angka 373. Rentang titik tetap bawah dan titik tetap atas thermometer Kelvin dibagi 100 skala

Perbandingan skala C : R : F = 100 : 80 : 180
C : R : F = 5 : 4 : 9
Dengan memperhatikan titik tetap bawah 00C = 00R = 320F, maka hubungan skala C, R dan F dapat ditulis sebagai berikut:

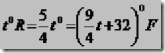

Hubungan skala Celcius dan Kelvin adalah

Kita dapat menentukan skala sendiri suatu termometer. Skala termometer yang kita buat dapat dikonversikan ke skala termometer yang lain jika saat menentukan titik tetap kedua termometer berada keadaan yang sama.
Misalnya kita akan menentukan skala termometer X dan Y. Termometer X dengan titik tetap bawah Xb dan titik tetap atas Xa. Termometer Y dengan titik tetap bawah Yb dan titik tetap atas Ya. Titik tetap bawah dan titik tetap atas kedua thermometer di atas adalah suhu saat es melebur dan suhu saat air mendidih pada tekanan 1 atmosfer. Misal X adalah suhu benda yang terukur oleh A dan Y adalah suhu benda yang terukur oleh B. Hubungan Skala kedua thermometer tersebut adalah:
| Dengan membandingkan perubahan suhu dengan interval kedua titik tetap masing-masing thermometer, diperoleh hubungan sebagai berikut: 
Xa = titik tetap atas ermometer X Xb = titik tetap bawah thermometer X Tx = suhu pada thermometer X Ya = titik tetap atas thermometer Y Yb = titik tetap bawah thermometer Y Ty = suhu pada thermometer Y | |

Contoh soal:
1. Siswa mengukur suhu benda menggunakan ermometer skala Celcius sebesar 800C. Berapa suhu benda itu jika siswa tersebut menggunakan termometer skala Reamur dan Fahrenheit.
Penyelesaian:
Diketahui: t = 800C
Ditanya : t0R dan t0F ?
Jawab:



2. Suatu termometer X mengukur suhu es sedang melebur pada -100X dan mengukur suhu air mendidih pada `1100X. Termometer Celcius mengukur suhu suatu benda adalah 400C. Berapa suhu benda tersebut jika diukur dengan termometer A.
Penyelesaian:
Diketahui : Xb = -100X, Xa = 1100X, t = 400C
Ditanya : t0X ?
Jawab:


 ;
; 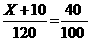 X = 380
X = 380
Latihan 1:
A. Isilah titik-titik dibawah ini dengan jawaban yang tepat!
- Pada termometer zat cair, yang paling baik cairannya adalah ....
- 1040F sama dengan .... 0C.
- 3030K = .... 0R
- Apa saja kebaikan air raksa dibanding alkohol dalam pengisian termometer!
- Isilah titik-titik berikut:
a. 900C = .... 0K
b. 640R = .... 0F
c. 1130F = .... 0K
B. Jawablah pertanyaan-pertanyaan di bawah ini dengan singkat dan tepat!
- Termometer Reamur mengukur suhu suatu benda 50oR. Berapa suhu benda tersebut jika diukur dengan thermometer skala
a. Celcius
b. Fahrenheit
c. Kelvin
- Suatu termometer mempunyai titik beku 200 dan titik didih 1000
a. Tuliskan hubungan Rumus termometer A dan termometer celcius!
b. Jika pada termometer A terbaca 810 tentukan angka pada skala celcius!
- Suatu termometer A mengukur suhu es sedang melebur pada 10oA dan mengukur suhu air mendidih pada 130oA. Suhu benda diukur dengan termometer skala celcius sebesar 50oC. Berapa suhu benda tersebut jika diukur dengan termometer A

| Kegiatan percobaan 1 - Judul percobaan: Termometer
- Tujuan percobaan: Menentukan skala thermometer
- Alat dan Bahan:
a. Thermometer yang belum diketahui skalanya b. Bongkahan es c. Bejana d. Pembakar Spiritu - Langkah kerja:
a. Masukkan bongkahan es ke dalam bejana kemudian panaskan. b. Amati tinggi raksa pada thermometer saat es melebur c. Tandai garis pada termometer dengan spidol ketika es melebur d. Garis tersebut sebagai titik tetap bawah dan berilah angka tertentu.. e. Panaskan air hingga mendidih f. Amati tinggi raksa pada termometer saat air mendidih. g. Tandai garis pada termometer dengan spidol saat air mendidih h. Garis tersebut sebagai titik tetap atas dan berilah angka terntu.. i. Bagilah jarak antara titik tetap bawah dan titik tetap atas menjadi skala-skala yang sama besar. j. Gunakan thermometer tersebut untuk mengukur suhu suatu benda kemudian konversikan (ubahlah) ke dalam skala celcius, reamur dan Fahrenheit. - Analisis dan pembahasan:
Lakukan analisis terhadap hasil percobaan dan buat hasil pembahasannya - Buatlah laporan percobaan pada kertas folio dan kumpulkan ke guru pembimbing.
| |

KALOR
I. Standar Kompetensi
8. Menerapkan konsep suhu dan kalor
II. Kompetensi Dasar
8.2 Menguasai pengaruh kalor terhadap zat
8.3 Menguasai pengaruh kalor terhadap zat
8.4 Mengenal cara perpindahan kalor
III. Indikator
- Menjelaskan pengaruh kalor terhadap suhu dan wujud benda
2. Menjelaskan peristiwa perubahan wujud dan karakteristiknya dengan mengemukkan contoh dalam kehidupan sehari-hari
- Menganalisis perubahan wujud secara kuantitatif
- Menggunakan kalorimeter dalam menetukan besarnya kalor yang lepas atau diterima.
- Menemukan persamaan Asas black secara kuantitatif
- Merumuskan dan menerapkan kalor jenis dan kapasitas kalor dalam perhitungan
- Membanding-kan peristiwa perpindahan kalor secara konduksi, konveksi, radiasi
- Mengiidentifikasi faktor-faktor yang mempengaruhi peristiwa perpindahan kalor
- Mendemonstrasikan cara untuk mengurangi perpindahan kalor
IV. Materi Pelajaran
1.2 Pengaruh Kalor terhadap Suhu dan Perubahan Wujud Zat
- Pengertian Kalor
Jika kita memanaskan salah satu ujung batang logam, maka ujung lain dari batang itu akan ikut panas. Hal ini membuktikan bahwa kalor merambat dari bagian benda yang suhunya tinggi ke bagian yang suhunya rendah.
Jadi kalor (Q) adalah energi panas yang merambat dari benda yang suhunya tinggi ke benda yang suhunya rendah. Satuan kalor dalam SI adalah Joule. Satuan kalor yang juga sering digunakan adalah kalori. 1 kalori (kal) = 4,2 J atau 1J = 0,24 kalori
- Kalor jenis benda
Tidak seperti besaran fisika yang lain, kalor adalah besaran yang tidak dapat dilihat. Jumlah kalor yang diserap atau dilepas suatu benda hanya dapat diukur dengan mengamati pengaruhnya terhadap bahan disekitarnya. Untuk dapat merumuskan jumlah kalor maka Perhatikan percobaan berikut:
| |
| | | Pada gambar (a) kedua bejana diisi dengan zat cair yang sejenis dan dipanaskan dalam selang waktu yang sama. Ternyata pada bejana yang berisi zat cair lebih sedikit suhunya lebih tinggi. Jadi jumlah kalor yang diserap benda berbanding lurus dengan massa benda. ( Q ∞ m) Pada gambar (b) kedua benda diisi zat cair yang sejenis dan sama massanya. Ternyata pada selang waktu yang sama bejana yang dipanasi dengan api lebih besar memiliki suhu yang lebih tinggi. Jadi Jumlah kalor sebanding dengan kenaikan suhu (Q ∞ ∆T) | |

| Pada gambar (C) Bejana A diisi dengan alcohol dan bejana B diisi dengan air. Massa kedua zat cair di dalam masing-masing bejana sama. Ternyata dalam selang waktu yang sama, Suhu thermometer pada bejana A lebih tinggi dari thermometer pada bejana B. Kalor jenis alcohol lebih kecil dari kalor jenis air. Jadi kalor sebanding dengan kalor jenis. (Q ∞ c) | |

| Berdasarkan kesimpulan di atas maka jumlah kalor yang diserap atau dilepas suatu benda dapat dirumuskan Q = m c ∆T Dengan Q = jumlah kalor m = massa zat c = kalor jenis ∆T= kenaikan suhu | |

Kalor jenis benda adalah banyaknya kalor yang diperlukan tiap 1 gram zat untuk menaikkan suhunya sebesar 10C. Contoh kalor jenis air 4200 J/kg0C, artinya adalah untuk memanaskan suhu 1 kg air sebesar 10C diperlukan energi sebasar 4200 J. Untuk zat yang jenisnya sama memiliki kalor jenis yang sama besar. Nilai kalor jenis berbagai benda adalah sebagai berikut:
Tabel 5.1 Kalor jenis beberapa zat
| No | Nama Zat | Kalor jenis (J/kgK) |
| 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. | Air Alcohol Gliserin Paraffin Es Kayu Aluminium Kaca Besi Tembaga Kuningan Karet Timah hitam Raksa | 4,2 x 103 2,5 x 103 2,4 x 103 2,2 x 103 2,1 x 103 1,7 x 103 9,1 x 102 6,7 x 102 4,7 x 102 3,9 x 102 3,8 x 102 1,7 x 102 1,3 x 102 1,4 x 102 |
Kapasitas kalor (C) adalah banyaknya kalor yang diperlukan zat untuk menaikkan suhunya sebesar 10C. Untuk zat yang sejenis belum tentu memiliki kapasitas kalor yang sama. Secara matematis, kapasiyas kalor dirumuskan sebagai berikut:

karena 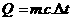 maka
maka  Satuan kapasitas kalor adalah J/K
Satuan kapasitas kalor adalah J/K
2.3 Perubahan Wujud Zat
Perhatikan percobaan berikut
| Sebongkah es yang dipanasi maka mula-mula berubah wujud menjadi cair. Apabila pemanasan dilakukan terus maka air dalam bejana berubah wujud menjadi uap. Jadi kalor disamping juga dapat menyebabkan perubahan wujud pada suatu benda. | |

a. Perubahan wujud zat dari padat menjadi cair
Perubahan wujud zat dari padat menjadi cair disebut mencair atau melebur. Contoh es berubah menjadi air. Zat padat berubah menjadi cair pada suhu tertentu yang disebut titik lebur zat. Sebagai contoh: pada tekanan normal 1 atmosfer es melebur pada suhu 00C. Pada saat melebur suhu zat tetap. Jumlah kalor yang diperlukan untuk meleburkan suatu zat padat dipengaruhi oleh massa zat itu dan kalor leburnya. Secara matematis dapat ditulis:

m = menyatakan massa zat (kg)
L = menyatakan kalor zat (J/kg).
Kalor lebur zat (L) adalah jumlah kalor yang diperlukan untuk mengubah wujud 1 kg zat padat menjadi zat cair pada titik leburnya.
b. Perubahan wujud zat dari cair menjadi gas
| |
| | | Jika kita merebus air, maka pada air tersebut mula-mula akan muncul gelembug gas. Pada saat ini zat cair dikatakan mulai menguap. Apabila pemanasan kita teruskan maka gelembung semakin banyak dan terjadi penguapan pada seluruh bagian atau mendidih. | |

Gambar 2.5 penguapan zat cair
Zat cair mendidih pada suhu tertentu yang disebut titik didih zat. Saat mendidih, suhu zat tetap. Contoh pada tekanan normal (1 atmosfer) air mendidih pada suhu 1000C. Jumlah kalor yang diperlukan untuk mengubah wujud zat cair menjadi uap dipengaruhi oleh:
a massa zat (m)
b. kalor uap zat (U). Secara matematis dirumuskan

m = massa zat (kg)
U = kalor uap zat (J/kg)
Kalor uap adalah jumlah kalor yang diperlukan untuk mengubah wujud 1 kg zat cair menjadi uap pada titik didihnya.
Penguapan zat cair dapat dipercepat dengan cara antara lain;
- memanaskan
- memperluas permukaan
- meniupkan udara
- menurunkan tekanan
- menyemburkan zat cair
Perubahan wujud zat dapat digambarkan dalam bentuk grafik sebagai berikut. Misalkan m kg es yang suhunya –t0C diubah seluruhnya menjadi uap yang suhunya t0C (t > 1000C)

Pada grafik ab Kalor yang diserap adalah Qab = mces∆t es.
Pada grafik bc, kalor yang diserap untuk meleburkan es adalah Qcd = mL.
Pada grafik cd, Kalor yang diserap untuk menaikkan suhu air adalah Qcd = m.cair ∆t air.
Pada grafik de, Kalor yang diserap untuk menguapkan zat cair adalah Qde = mU.
Pada grafik ef, kalor yang diserap untuk menaikkan suhu uap adalah Qef = mcuap∆t uap.
Jumlah kalor yang diperlukan untuk mengubah wujud es dari –t0C menjadi uap seluruhnya t0C adalah:
Q = Qab + Qbc + Qcd + Qde + Qef.
Contoh Soal:
- Hitung jumlah kalor dalam joule yang diperlukan untuk meleburkan 400 gram es pada 0oC jika kalor lebur es 80 kal/g.
Penyelesaian:
Diketahui: m = 00g
L = 80 kal/g
Ditanya: Q?
Jawab: Q = m.l
Q = 400g . 80 kal/g
Q = 32.000 kal.
Q = 32.000 x 4,2 J = 134400 J
- Untuk mengubah air menjadi uap seluruhnya pada suhu 100oC diperlukan energi sebesar 270000 kal. Berapa massa air tersebut jika kalor uap air 540 kal/g.
Penyelesaian:
Diketahui: Q = 108000 kal
U = 540 kal/g
Ditanya: m?
Jawab: m = Q/U
m = 270000 /540 m = 500 gram = 0,5 kg
Latihan 2
I. Jawablah pertanyaan-pertanyaan di bawah ini dengan singkat dan tepat!
1. Apa yang dimaksud dengan:
a. kalor
b. Kalor jenis
c. Kapasitas kalor
2. Berapakah besarnya kapasitas kalor zat yang massanya 350 gram diberi kalor sebesar 200 kalori sehingga suhunya naik 40C?
3. Hitung jumlah kalor yang diperlukan untuk mengubah 500 gram es yang suhunya -20oC menjadi uap pada suhu 100oC. (ces= 0,5 kal/goC, cair= 1kal/goC, Les = 80 kal/g, U = 540 kal/g)
4. Untuk mengubah 200 gram zat pada menjadi zat cair pada titik leburnya diperlukan kalor sebesar 45.000 J. tentukan kalor lebur zat tersebut.
c. Azas Black
Apabila kita akan membuat segelas air teh hangat, maka kita mencampur air panas dan air dingin. Untuk memahami proses pertukaran kalor pada campuran tersebut, perhatikan gambar berikut;
| Bejana (a) kita isi dengan air panas massanya m1 dan suhunya T1. Bejana (b) kita isi dengan air dingin massanya m2 dan suhunya T2. Bejana (c) adalah campuran air dari bejan (a) dan bejana (b) . Suhu campuran air pada bejana c yaitu Tc. | |

Hasil pengamatan diperoleh, suhu T1<Tc<T2. Dalam hal ini air panas yang berasal dari bejana (a) melepaskan kalor sehingga suhunya turun. Air dingin yang berasal dari bejan (b) menyerap kalor sehingga suhunya naik.
Kalau kita hitung jumlah kalor yang dilepas oleh air panas adalah
Q lepas = m1.ca (T1-Tc). ………………………………………………………………. (1)
Kalor yang diserap oleh air dingin adalah Q serap = m2.ca (Tc-T2). ………………….. (2)
Kalau kita bandingkan maka Q lepas sama dengan Q serap. Perumusan banyaknya kalor yang diserap dan kalor yang dilepas suatu benda dikenal dengan azas Black, yaitu:
Jika dua benda yang berbeda suhunya dicampur maka benda yang suhunya lebih tinggi akan melepas kalor yang jumlahnya sama dengan kalor yang diserap oleh bend ayng suhunya lebih rendah.
Secara matematis azas blak dapat ditulis:
Qlepas = Qserap................................................ (3)
Contoh soal:
Benda massa 200 gram suhunya 1000C dimasukkan ke dalam bejana yang berisi 400 gram air dan suhunya 100C. Jika suhu campuran adalah 600C maka tentukan kalor jenis benda tersebut. (kalor jenis air 1 kal/g0C)
Penyelesaian:
Diketahui:
m1= 200g m2 = 400g
T1 = 1000C T2 = 100C
Tc = 600C c2 = 1 kal/g0C
Ditanya: c1 ?
Jawab: Q1 = Q2
m1c1∆T1 = m2c2∆T2
200 x 1 . (100-60) = 400 x c2 .(60-10)
40 = 100 x c2
c2 = 0,4 kal/g0C.
Latihan 3
- Sepotong logam bermassa 4 kg dipanaskan dari suhu 200C menjadi 300C menggunakan pemanas listrik berdaya 800 watt. Ternyata untuk itu diperlukan waktu 16 detik. Jika efisiensi pemanas tersebut 100%. Tentukan.
a. Kalor jenis logam
b. Kapasitas kalor logam
- Sebatang logam bermassa 400 gram dipanaskan sampai 800C lalu dimasukkan ke dalam 800 gram air pada suhu 100C (kalor jenis air 1 kal/g0C). Jika suhu akhir timah dan air adalah 120C. Berapa kalor jenis timah tersebut?
- 400 gram es suhunya 0oC dimasukkan 800 air yang suhunya 80oC. Dalam keadaan seimbang tentukan suhu campuran tersebut (ces = 0,5 kal/goC, cair = 1 kal/goC dan L = 80 kal/g)
- 200 gram benda suhunya 100oC dimasukkan ke dalam 400 gram air yang suhunya 10oC. Jika suhu
2. 4 Pemuaian Zat
Coba kalian amati bingkai kaca jendela ruang kelasmu. Ternyata ada beberapa bingkai jendela yang melengkung sehingga tidak tepat pada jendela. Mengapa bingkai jendela tersebut melengkung?. Bingkai jendela tersebut melengkung tidak lain mengalami pemuaian.
Pemuaian yang terjadi pada benda sebenarnya terjadi pada seluruh bagian benda tersebut. Namun demikian untuk mempermudah pemahaman maka pemuaian dibedakan tiga macam yaitu pemuaian panjang, pemuaian luas dan pemuaian volume.
a. Pemuaian Panjang
Kalau kita berjalan-jalan distasiun kereta api, maka kita akan melahat ada beberapa rel kereta api yang melengkung. Rel tersebut melengkung karena mengalai pemuaian panjang akibat sinar matahari.

Gambar di atas adalah alat muschenbroek, yaitu alat yang digunakan untuk menyelidiki pemuaian panjang berbagai jenis zat padat. Pemuaian panjang suatu benda dipengaruhi oleh panjang mula-mula benda, besar kenaikan suhu dan tergantung dari jenis benda. Pertambahan panjang benda akibat pemuaian dapat dirumuskan:
Jika panjang benda mula-mula Lo1 pada suhu t1, dipanaskan sampai suhu t2, sehingga mengalami pertambahan panjang DL maka panjang benda setelah dinaikkan suhunya adalah sebagai berikut :
Lt = Lo + DL jika DL = Lo . a . Dt, maka :
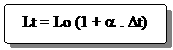 Lt = Lo + Lo . a . Dt
Lt = Lo + Lo . a . Dt
Keterangan:
Lo = panjang benda mula-mula (m)
DL = pertambahan panjang (m)
Dt = t2 – t1 = kenaikan suhu (0C)
Lt = panjang benda setelah dipanaskan (m)
a = koefisien muai panjang (/ 0C)
Tabel 6.2. Koefisien berbagai jenis bahan
| No | Nama Bahan | Koefisien muai panjang (/0C |
| 1. 2. 3. 4. 5. 6. 7. 8. 9. 10 | Seng Kuningan Tembaga Besi Aluminium Baja Platina Kaca Pyrex Baja invar | 2,5 x 10-5 1,9 x 10-5 1,8 x 10-5 1,2 x 10-5 1,2 x 10-5 1,1 x 10-5 1,0 x 10-5 0,9 x 10-5 0,3 x 10-5 0,1 x 10-5 |
b. Pemuian Luas
Pemuaian luas pada benda jika benda dianggap sebagai plat tipis. Misalkan palt tipis berbentuk persegi dengan panjang sisi mula-mula ao.
Dengan cara yang sama, untuk muai luas benda akan didapatkan persamaan matematika sebagai berikut :
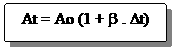
 At = AO + DA
At = AO + DA
DA = AO . b . Dt
Ao = luas benda mula-mula (m2)
At = luas benda setelah dipanaskan (m2)
b = Koefisien muai luas (/ 0C)
Dimana harga b = 2a
c. Pemuaian Volume

Untuk muai volume, berlaku persamaan matematika sebagai berikut

 Vt = Vo + DV
Vt = Vo + DV
DV = Vo . g . Dt
Vo = volume benda mula-mula (m3)
Vt = volume benda setelah dipanaskan (m3)
g = koefisien muai volume (/ 0C)
Dimana g = 3a atau g = 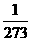
Contoh Soal:
- Batang suatu logam pada suhu 10oC memiliki panjang 100 cm. Tentukan panjang tersebut pada suhu 310oC jika α = 1,2 x 10-5/oC.
Penyelesaian:
Diketahui: lo = 100 cm
∆T= 300oC
Ditanya: l?
Jawab: l = lo(1 + α ∆T)
l = 100(1 + 1,2 x 10-5/oC x 300 oC)
l = 100 + 0,36
l = 100,36 cm.
- Suatu plat aluminium berbentuk persegi dengan panjang sisi 20 cm pada suhu 25oC. loefisien muai panjang aluminium 1,2 x 10-5/oC. Tentukan pertambahan luas plat tersebut jika dipanasi higga suhu 125oC.
Penyelesaian:
Diketahui: ao = 20 cm, Ao = 400 cm2
∆T= 100oC
β = 2 x 1,2 x 10-5/oC = 2,4 x 10-5/oC
Ditanya: ∆A?
Jawab: ∆A = Ao β∆T
∆A = 400 cm2 x 2,4 x 10-5/oC x 100oC
∆A = 0,96 cm2
Latihan 4
- Batang logam panjangnya 300 cm dipaskan dari 25oC hingga 225oC mengalami pertambahan panjang sebesar 0,6 cm. Berapa pertambahan batang logam yang sama dengan panjang 200 cm dan dipaskan dari 20oC hingga suhu 320oC
- Besi berbentuk kubus pada suhu 20oC memiliki panjang rusuk 10 cm. Kubus tersebut dipanaskan hingga suhu 220oC. Berapa volume kubus pada suhu 220oC jika koefisien muai panjang besi 1,2 x 105/oC.
d. Pemuaian pada Gas
Mungkin kalian pernah menyaksikan mobil yang sedang melaju dijalan tiba-tiba ban mobilnya meletus. Ban mobil tersebut meletus karena adanya pemuaian udara atau gas di dalam ban tersebut. Pemuaian tersebut terjadi karena adanya kenaikan suhu udara di ban mobil akibat gesekan roda dengan aspal.

 Pemuaian yang terjadi adalah pemuaian volume :
Pemuaian yang terjadi adalah pemuaian volume :
Jika suatu bejana berisi penuh zat cair, kemudian dipanaskan, maka zat cair tersebut tumpah/tidak.

Syarat tumpah g cair > g padat
Zat cair yang tumpah = Vo . Dt ( gcair - gpadat )
Pemuaian gas dibedakan tiga macam, yaitu:
- pemuaian gas pada suhu tetap (isotermal)
- pemuaian gas pada tekanan tetap
- pemuaian gas pada vole tetap.
Pemuaian gas pada suhu tetap (isotermal)
| |
| | | Hukum Boyle: Gas di dalam ruang tertutup yang suhunya dijaga tetap, maka hasil kali tekanan dan volume gas adalah tetap. PV = tetap Atau P1V1=P2V2 P = tekakan gas ………… pa V = Volume gas …………m3 | |
Pemuaian gas pada tekanan tetap (isobar)
Hukum Gay lussac:
Gas di dalam ruang tertutup dengan tekanan dijaga tetap, maka volume gas sebanding dengan suhu mutlak gas.
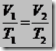
Pemuaian gas pada volume tetap (isokhorik)
Jika volume gas di dalam ruang tertutup dijaga tetap, maka tekanan gas sebanding dengan suhu mutlaknya.
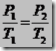
Hukum Boyle – Gay lussac
Dengan menggabungkan hukum boyle dan hukum Gay Lussac diperoleh persamaan sebagai berikut.


Contoh Soal:
- Suatu gas di dalam ruang tertutup memiliki tekanan 1 atm dan volume 4 L. Jika suhu gas dijaga tetap dan tekanan diubah menjadi 2 atm, maka volume gas menjadi?
Penyelesaian:
Diketahui:
P1= 1 atm V1= 2 L
P2= 2 atm
Ditanya V2?
Jawab:
P1V1=P2V2
1 atm . 4L = 2 atm. V2
V2 = 2L
- Suatu gas di dalam ruangan tertutup memiliki tekanan 1 atm, suhu 27oC dan volume 2,4L. Berapa volume gas tersebut pada suhu 127oC?
Penyelesaian
Diketahui:
P = 1 atm
T1 = 27oC = 300 K V1 = 2,4 L
T2 = 127oC = 400 K
Diatanya V2
Jawab:


V2 = 3,2 L
Latihan 5
- Suatu gas suhunya 27oC dipanaskan pada tekanan tetap. Berapa suhu gas tersebut saat volume gas menjadi 3 kali volume semula?
- Suatu gas di dalam ruang tertutup pada suhu 27oC dan tekanan 2 atm memiliki volume 2,4 L. Berapa volume gas tersebut pada suhu 227oC dan tekanan 3 atm?
2.5 Perpindahan Kalor
Kita telah membahas bahwa kalor adalah bentuk energi panas. Apabila kita memegang batang logam dan salah satu ujung batang itu dipanaskan dengan lilin maka tangan kita yang memegang ujung lain dari batang itu akan merasakan panas. Hal ini membuktikan bahwa kalor merambat di dalam batang logam tersebut. Panas tersebut merambat dari ujung batang yang kita panasi ke ujung batang yang kita pegang. Jadi kalor merambat dari benda yang suhunya tinggi ke benda yang suhunya lebih rendah. Kalor berpindah melalui tiga cara, yaitu konduksi, konveksi dan radiasi.
a. Perpindahan kalor secara konduksi

Perhatikan gambar (a) di atas, batang logam dengan ujung A dipanaskan dan ujung B diberi lilin. Ternyata lilin di ujung B meleleh. Partikel-partikel pada ujung A tidak ikut berpindah ke ujung B. Perpindahan ini disebut konduksi.
Jadi perpindahan kalor secara konduksi adalah perpindahan kalor yang melalui zat perantara tanpa diikuti perpindahan bagian-bagian zat tersebut. Jumlah kalor yang berpindah melalui zat tiap sekon disebut laju perpindahan kalor (Q/t).
Hubungan laju perpindahan kalor dengan panjang batang logam
| Lilin pada gambar (a) lebih cepat meleleh dari lilin pada gambar (b). Panjang logam (a) lebih pendek dari logam (b). Jadi Laju perpindahan kalor berbanding terbalik dengan panjang logam. | |

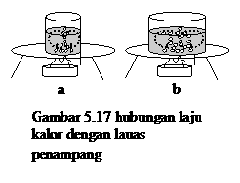
Hubungan laju perpindahan kalor dengan luas penampang
| | | | |
| |  |
| | | | Lilin pada gambar (a) lebih cepat meleleh dari lilin pada gambar (b). Luas penampang (A) logam (a) lebih besar dari logam (b). Jadi Laju perpindahan kalor berbanding lurus dengan luas penampang logam (A). | |
| |
Gambar 5.13 hubungan laju kalor
dengan luas penampang
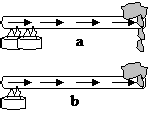
Hubungan laju perpindahan kalor dengan kenaikkan suhu
| | | | |
| | | | Lilin pada gambar (a) lebih cepat meleleh dari lilin pada gambar (b). Perbedaan suhu (∆T) pada logam (a) lebih besar dari logam (b). Jadi Laju perpindahan kalor berbanding lurus dengan luas perbedaan suhu logam (∆T). | |
| |  |
| |
Gambar 5.14 hubungan laju kalor
dengan kenaikan suhu
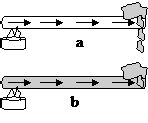
Pengaruh jenis bahan terhadap laju perpindahan kalor
| | | | |
| | | | Lilin pada gambar (a) lebih cepat meleleh dari lilin pada gambar (b). Jenis logam (a) berbeda dengan logam (b). Jadi Laju perpindahan kalor dipengaruhi oleh jenis logam. | |
| |  |
| |
Gambar 5.15 pengaruh jenis bahan
terhadap laju kalor
Berdasarkan keterangan di atas maka laju perpindahan kalor (Q/t) dipengaruhi oleh panjang, luas penampang, perbedaan suhu ujung-ujung batang logam dan tergantung pada jenis bahan. Secara matematis laju kalor dapat dirumuskan:
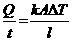
Q/t = Laju perpindahan kalor (J/s)
k = konduktivitas termal bahan (w/mK)
A = Luas penampang bahan (m2)
∆T = Perbedaan suhu ujung-ujung logam (K)
l = Panjang atau tebal bahan (m)
Benda-benda yang mudah menghantarkan kalor disebut konduktor. Contoh konduktor adalah besi, alumunium, baja tembaga dan lain-lian. Benda yang sukar menghantarkan kalor disebut isolator. Contoh isolator adalah plastic, kayu, kain dan lain-lain.
b. Perpindahan kalor secara konveksi
Perhatikan percobaan berikut:
| |
| | | Perhatikan gambar di samping: Bagian air yang panas mula-mula di bawah. Air yang panas tersebut bergerak ke atas. Sementara tempat yang ditinggalkan diisi oleh air dingin yang berada di atasnya. Demikian seterusnya sehingga terjadi gerakan partikel air sekaligus memindahkan panas. Perpindahan panas demikian disebut konveksi. Jadi perpindahan kalor secara konveksi adalah perpindahan kalor melalui zat perantara diikuti perpindahan partikel-partikel zat tersebut. | |

Contoh perpindahan kalor secara konveksi dalam kehidupan sehari-hari antara lain adalah:
a. perpindahan kalor pada air saat direbus
b. perpindahan kalor dari pengering rambut
c. aliran udara dari kipas angin.
d. System pendingin ruangan
e. kulkas
Laju pepindahan kalor secara konduksi:
Hubungan laju perpindahan kalor dan luas penampang (A)
| Luas penampang permukaan air pada gambar (a) lebih kecil dari luas penampang air pada gambar (b). Dengan pemanasan api yang sama maka air pada bejana (b) lebih cepat panas. Jadi laju kalor secara konveksi berbanding lurus dengan luas penampang (A). | |
Hubungan laju perpindahan kalor dengan kenaikan suhu (∆T)
| |
| | | Pada saat yang sama kenaikan suhu pada bejana (b) lebih besar dari Bejana (a). Ternyata air pada bejana (b) lebih cepat panas dari air pada bejana (a). Jadi laju perpindahan kalor secara konveksi berbanding lurus dengan kenaikan suhu (∆T). | |

sHubungan laju perpindahan kalor dengan jenis bahan
| |
| | | Kedua bejana diisi dengan air yang berbeda jenis. Air pada bejana (b) lebih cepat panas dari air bejana (a). Jadi laju kalor secara konduksi tergantung pada jenis bahan. | |

Dengan demikian dapat disimpilkan bahwa laju kalor secara konveksi dipengaruhi oleh luas penampang (A), kenaikan suhu (∆T) dan tergantung pada jenis bahan. Secara matematis dapat ditulis:

h = koefisien konveksi(w/m2K)
A = luas penampang (m2)
∆T= kenaikkan suhu (K)
Q/t= laju perpindahan kalor (J/s atau w)
c. Perpindahan kalor secara radiasi.
| |
| | | Kalian tentunya pernah mengikuti kegiatan pramuka bukan? Biasanya dalam kegiatan pramuka diadakan api unggun pada malam hari dan para anggota pramuka duduk mengitari api unggun tersebut. Setiap anggota pramuka merasakan hangatnya api unggun tersebut. Hal ini menandakan bahwa kalor dari api unggun dipancarkan secara langsung ke segala arah. Perpindahan kalor demikian disebut radiasi atau pancaran. | |

Jadi perpindahan kalor secara radiasi adalah perpindahan kalor yang dipancarkan secara langsung tanpa melalui zat perantara.
Contoh radiasi kalor dalam kehidupan sehari-hari antara lain adalah:
- pancaran kalor dari api unggun
- pancaran kalor dari lampu
- Cahaya dari matahari.
Semua benda memiliki kemampuan untuk memancarkan kalor dan menyerap kalor. Benda yang permukaanya putih mengkilap adalah pemancar dan penyerap kalor yang jelek Benda yang permukaannya hitam atau gelap adalah pemancar dan penyerap kalor yan baik.
Laju pancaran kalor suatu benda diselidiki oleh Stefan dengan menggunakan pendekatan terhadap benda hitan sempurna. Menurut Stefan, laju pancaran kalor tiap satuan luas permukaan dari benda hitam sempurna berbanding lurus dengan pangkat empat dari suhu mutlaknya. Secara matematis laju pancaran kalor dapat ditulis:

e = emisivitas bahan (untuk benda hitam sempurna nilai e = 1)
σ = tetapan Stefan (5,67 x 10-8 w/m2K4)
A = luas penampang (m2)
T = Suhu mutlak (K)
Q/t = Laju kalor (J/s atau watt)


Contoh soal:
- Suatu plat besi berbentuk persegi dengan luas bidang 2000 cm2 dan tebal 4 cm.. Jika perbedaan suhu kedua permuaan 40K dan konduktivitar termal bahan adal 4,8 w/mK, tentukan laju perpindahan kalor pada plat tersebut.
Penyelesaian
Diketahui:
A = 2000 cm2 = 0,2 m2
l = 4 cm = 0,04 m
∆T= 40K
k = 4,8 w/mK
Ditanya: Q/t ?
Jawab:
![clip_image088[1] clip_image088[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjZb9Iodv0HZLhpqs9K8B1BzSc0EeUNfFG1dkBmjnLKhHlMRtFOB9F51IGalsHDZkY87wxkCL4kT19kRzkJxb_SzUPAIn78rzT43s-j_tCgUHU32PS3Co44ow8QnEFrI3dwdqngnNU2foc/?imgmax=800)

- Suhu udara di dalam suatu kamar adalah 26oC. Seseorang dengan luas permukaan tubuhnya 1 m2 memiliki suhu badan 36oC berada di dalam kamar terseut. Jika koefisien konveksi orang tersebut 7 w/m2K, tentukan jumlah kalor yyang dilepas orang tersebut selama 1 menit.
Penyelesaian:
Diketahui:
∆T = 10oC = 10K
A = 1 m2
h = 7 w/m2K
t = 1 menit = 60 s
Ditanya: Q ?
Jawab:
Q = h A ∆T t
Q = 7.1.10.60 = 4200 J
- Suatu benda hitam dengan luas permukaan 100 cm2 memiliki suhu 127oC. Tentukan jumlah energi yang dipancarkan benda hitam tersebut selama 1 menit.
Penyelesaian:
Diketahui:
A = 100 cm2 = 0,01 m2
T = 127 oC = 400 K
t = 1 menit = 60 s
e = 1
σ = tetapan Stefan (5,67 x 10-8 w/m2K4)
Ditanya: Q ?
Q = e σAT4t
Q = 1.(5,67 x 10-8). 0,01. (400)4.60
Q = 87,09 J
Latihan 6
Isilah titik-titik dibawah ini dengan jawaban yang tepat!
- Jika koefisien muai panjang = a, koefisien muai luas = b dan koefisien muai volume = j, maka a = .... b = .... g.
- Batang baja pada suhu 283 K panjangnya 50 cm. Jika koefisien muai panjang baja = 1,1 x 10-5/0K, maka panjang baja pada suhu 383 K adalah ....
- Panjang sebatang logam pada suhu 250C adalah 4 meter dan pada suhu 1050C panjangnya 402cm, koefisien muai panjang logam adalah ....
- Rambatan kalor pada zat cair dan gas dengan disertai perpindahan massa disebut ...
- Perpindahan kalor dari matahari ke bumi disebut ....
- Sebuah benda hitam jika suhunya naik menjadi 4 kali emula maka energi yang dipancarkan menjadi .... kali.
- Besarnya energi kalor yang dipancarkan tiap detik oleh benda hitam sempurna seluas 2 m2. Pada suhu 100 K adalah ....
- Dua buah batang logam P dan Q dengan ukuran yang sama tetapi jenisnya berbeda, dilekatkan seperti gambar. Ujung kiri P bersuhu 800C dan ujung kanan Q bersuhu 100C. Jika koefisien konduksi termal P = 2 kali koefisien konduksi termal Q, tentukan suhu bidang batas P dan Q!
- Dua logam A dan B memiliki luas penampang dan panjang yang sama di sambung jadi satu. Suhu pada ujun bebas A adalah 20oC dan suhu pada ujung bebas B adalah 120oC. Jika konduktivitas termal logam A dua kali konduktivitas logam B, maka suhu sambungan kedua logam tersebut adalah…
- Tentukan jumlah kalor yang dipancarkan benda hitam berbentuk bola dengan diameter 20 cm dan suhu permukaannya 127oC.
1.6 Mengurangi/mencegah perpindahan kalor
Adanya perpindahan kalor disamping menguntungkan juga menyebabkan kerugian. Contoh kerugian adalah air minum yang kita masak akan segera dingin setelah beberapa waktu. Demikian pula bahan-bahan makanan yang kita masak juga segera dingin. Untuk mengatasi kerugian tersebut maka dibuat alat yang dapat memperkecil laju perpindahan kalor. Pernahkan kalian mengamati termos air atau termos nasi di rumahmu?

Termos adalah alat yang dapat mengurangi perpindahan kalor dari atau ke dalam termos. Air atau nasi yang kita simpan di dalam termos maka suhunya dapat kita jaga sampai bebera lama. Pada termos air, dinding termos dibuat rangkap dan di buat vacum agar tidak terjadi perpindahan kalor secara konduksi dan konveksi. Bagian dalam dinding dibuat mengkilap agar kalor dipancarkan kembali ke dalam termos.
Uji Kompetensi:
Pilihlah salah satu jawaban yang paling tepat dengan cara memberi tanda silang (X) pada huruf a, b, c, d, atau e!
1. Suatu plat baja luasnya 8 m2, suhu awalnya 25 0C, jika suhu dinaikkan menjadi 850C dan koefisien muai panjang baja 1 x 10-5 /0C, maka pertambahan luas baja adalah ....
a. 176 mm2 d. 1056 mm2
b. 132 mm2 e. 740 mm2
c. 2560 mm2
2. Silinder motor vespa yang terbuat dari baja pada suhu 20 0C, mempunyai volume langkah 150 cc. Jika suhu mesin naik menjadi 140 0C dan koefisien muai panjang baja 14 x 10-6 /0C maka volume silinder tersebut menjadi ....
a. 150,648 cc d. 150,198 cc
b. 150,297 cc e. 150,243 cc
c. 150,756 cc
3. Logam yang biasa digunakan untuk pengisian termometer adalah ....
a. Ag d. Mg
b. Pb e. Hg
c. Sn
4. Panas 4,18 joule adalah banyaknya kalor yang diperlukan untuk memanaskan
1 gram air murni sehingga ....
a. Suhunya naik 10 0C
b. Suhunya naik 1 0C
c. Suhunya naik 100 0C
d. Suhunya naik 5 0C
e. Suhunya naik 2 0C
5. Rumus kimia zat yang digunakan sebagai pengganti air raksa dalam termometer adalah ....
a. H2SO4 d. Ca (OH)2
b. NaCl e. C4H10
c. C2H5OH
6. Termometer Reamur menunjukkan 500 sama dengan .... 0F
a. 1580 d. 320
b. 10,670 e. 18,70
c. 1260
7. Selisih suhu suatu ujung batang logam adalah 30 0C. Dalam skala Fahrenheit selisih suhu adalah ....
a. 320 d. 540
b. 420 e. 860
c. 640
8. Pertambahan panjang yang dihasilkan dari proses pemanasan logam adalah ....
a. Berbanding lurus dengan panjang logam mula-mula
b. Berbanding terbalik dengan perubahan suhu
c. Berbanding terbalik dengan koefisien panjang
d. Berbanding terbalik dengan panjang setelah pemanasan
e. Berbanding lurus dengan kalor jenis
9. Suatu logam panjang 4 m dipanaskan dari 5 0C sampai 55 0C, Jika koefisien muai panjang logam 1,6 x 10-6 /0C maka panjang logam setelah pemanasan adalah ....
a. 4,032 m d. 4,32 m
b. 4,0032 m e. 4,325 m
c. 4,00032 m
10. Besarnya koefisien muai gas pada tekanan tetap untuk semua jenis gas adalah ....
a. ![clip_image064[1] clip_image064[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiYuzPPAjYwE52A0RW88umTJ5zTeSApoZFcZ7R44fw7g6en-nAzKofk_YmpryJI_v4_M7KXctrX4ZrFMZFOEF4XMJ7oMJ-fbTeAXuYcWdudtvd8KVKf3BYc9jyL-wcmXXGPShOdQscu5Ho/?imgmax=800) d. 0,82
d. 0,82
b. 0,273 e. 273
c. 0,082
11. Sebuah benda hitam jika suhunya naik menjadi 4 kali semula maka energi yang dipancarkan menjadi ....
a. 16 kali d. 128 kali
b. 32 kali e. 256 kali
c. 64 kali
12. Sebuah lubang kecil dalam suatu perapian dianggap sebagai benda hitam, luasnya 2 cm2 dan suhu perapian 927 0C jika V = 5,67 x 10-8 watt/m2K4, maka besarnya kalor yang dipancarkan lubang adalah ....
a. 5,6 watt d. 4,4 watt
b. 1,12 watt e. 560 watt
c. 11,2 watt
13. Suatu benda hitam pada suhu 127 0C memancarkan energi sebesar W joule/S benda tersebut kemudian dipanaskan hingga suhunya mencapai 527 0C. energi yang dipancarkan benda hitam menjadi ....
a. 4 kali d. 12 kali
b. 8 kali e. 16 kali
c. 10 kali
14. Sebuah benda hitam sempurna luasnya 4 m2, bersuhu 300 K, jika s = 5,67 x 10-8 watt/m2K4, maka besarnya energi kalor yang dipanaskan adalah ....
a. 459,27 watt d. 918,54 watt
b. 1837,08 watt e. 2296,35 watt
c. 1377,81 watt
15. Dalam peristiwa radiasi kalor oleh sebuah benda yang paling menentukan besar kecilnya kalor adalah ....
a. Reaksinya d. Suhunya
b. Luas permukaannya e. Panjangnya
c. Massa jenisnya
16. Perpindahan kalor yang terjadi pada suatu zat tanpa disertai dengan perpindahan partikel zat tersebut disebut ....
a. Konveksi d. Resonansi
b. Radiasi e. Isolasi
c. Konduksi
17. Perpindahan kalor yang tidak memerlukan medium perantara disebut ....
a. Resonansi d. Konduksi
b. Isolasi e. Radiasi
c. Konveksi
18. Besarnya kalor yang merambat secara konveksi pada zat cair adalah ....
a. H = h . A . DT d. H = es . TA4 – TB4
b. H = e v . T4 e. H = k . 
c. H = k . L. DT
19. Batang alumunium panjangnya 2m, luas penampangnya 80 mm2. Ujung-ujung batang bersuhu 100C dan 500C. Besarnya kalor yang merambat tiap detik adalah ....
a. 0,002 kal/s
b. 0,004 kal/s
c. 0,006 kal/s
d. 0,008 kal/s
e. 0,01 kal/s
20. Sebuah keping tembaga tebalnya 5 mm luas penampang 8000 cm2. Sisi yang satu bersuhu 120 0C dan sisi lainnya bersuhu 140 0C. Jika koefisien konduksi termal besi = 4,6 x 10-3 Kj/m.sK, maka besarnya kalor yang berpindah melewati keping adalah ....
a. 7,15 Kj/s d. 10,42 Kj/s
b. 14.32 Kj/s e. 20,12 Kj/s
c. 3,86 Kj/s
21. Silinder motor vespa yang terbuat dari baja pada suhu 25 0C mempunyai volume langkah 150 cc. Volume langkah silinder pada suhu 135 0C (koefisien muai panjang baja 12 x 10-6 /0C) adalah ....
a. 150,864 cc d. 150,243 cc
b. 150,729 cc d. 150,198 cc
c. 150,594 cc
22. Ketel uap massanya 3500 kg berisi 1200 kg air yang suhunya 200C. Kalor jenis
1 kal/g0C dan kalor jenis besi 0,11 kal/g0C. Jumlah kalor yang diperlukan pada pemanasan awal mencapai 100 0C adalah ....
a. 30,800 Kkal d. 96.000 Kkal
b. 36,500 Kkal e. 126.800 Kkal
c. 65.200 Kkal
23. Panas 4,18 joule ialah banyaknya kalor yang diperlukan untuk memanaskan
1 gram air murni sehingga ....
a. Suhunya naik 50C
b. Suhunya naik 10C
c. Suhunya naik 30C
d. Suhunya naik 40C
e. Suhunya naik 100C
24. Pada pengukuran suhu badan dengan termometer Celcius menunjukkan skala 700C. Jika diukur dengan termometer Fahrenheit menunjukkan angka ....
a. 790F d. 1260F
b. 1020F e. 1410F
c. 1580F
25. Pada pengukuran zat cair mendidih dengan termometer Celcius adalah 60 0C. Jika diukur dengan termometer Reamur, Fahrenheit dan kelvin, masing-masing adalah ....
a. R = 480, F = 1400, K = 3330
b. R = 750, F = 1400, K = 3000
c. R = 500, F = 1080, K = 3000
d. R = 480, F = 1080, K = 3000
e. R = 480, F = 1080, K = 3330
26. Pertambahan panjang logam jika dipanasi
a. Sebanding dengan panjang mula-mula dan jenis logamnya
b. Sebanding panjang mula-mula dan kenaikan suhunya
c. Tergantung jenis logam dan kenaikan suhunya
d. Tergantung panjang mula-mula, jenis logam dan kenaikan suhunya
e. Tergantung panjang mula-mula logamnya
27. Suatu batang tembaga panjangnya 2,5 m dan pada suhu 15 0C. Jika koefisien muai panjang tembaga 1,7 x 10-6 /K, maka pada pemanasan sampai suhu 35 0C pertambahan panjang batang ....
a. 2 mm d. 0,5 mm
b. 1,5 mm e. 0,2 m
c. 0,85 mm
28. Besarnya koefisien muai gas pada tekanan tetap untuk semua jenis gas adalah ....
a. 273 d. 0,82
b. 0,082 e. 1/273
c. 0,273
29. Suatu plat baja seluas 4 m2 suhunya 20 0C suhu dinaikkan menjadi 120 0C. Jika koefisien muai panjang baja 11 x 10-6 /0C, maka luasnya sekarang adalah ....
a. 4,0088 m2
b. 40,088 m2
c. 4,088 m2
d. 4,808 m2
e. 4,2808 m2
30. Volume gas oksigen pada tekanan 1,01 x 103 N/m2 dan suhunya 10 0C adalah
1 x 10-2 m3, jika tekanan menjadi 120 x 103 N/m dan suhunya 100 0C, maka volume gas tersebut sekarang adalah ....
a. 1,1 x 10-2 m3 d. 2,8 x 10-2 m3
b. 1,4 x 10-2 m3 e. 33,67 x 10-2 m3
c. 1,85 x 10-2 m3
31. Sebuah benda pada suhu 10 0C panjangnya 4 meter. Jika koefisien muai panjangnya 5 x 10-4 /0C maka panjang benda pada suhu 70 0C adalah ....
a. 4,48 m d. 4,12 m
b. 4,04 m e. 4,102 m
c. 4,24 m
32. Sebuah logam mempunyai koefisien muai panjang 11 x 10-5 /0C, dipanaskan dari suhu 30 0C sehingga mengalami pertambahan panjangnya sebesar 0,055 m. Panjang mula-mula logam tersebut adalah ....
a. 10 m d. 0,01 m
b. 0,1 m e. 1 m
c. 100 m
33. Suatu zat mempunyai kapasitas kalor 5 kal/0C, jika 40 kg zat tersebut diberi kalor 80 Kkal suhunya naik 40 0C, maka massa zat tersebut adalah ....
a. 50 gram d. 400 gram
b. 100 gram e. 300 gram
c. 200 gram
34. Termometer Reamur menunjukkan 480 sama dengan .... 0F
a. 80 d. 321
b. 108 e. 381
c. 140
35. Selisih suhu suatu ujung batang logam adalah 800C, maka selisih suhu tersebut sama dengan .... 0F
a. 60 d. 95
b. 95 e. 167
c. 176

TERMODINAMIKA

Standar Kompetensi
9. Menerapkan hukum termodinamika
Kompetensi Dasar
9.1 Mendeskripsikan sifat –sifat gas ideal dan persamaan keadaan gas
9.2 Memahami hukum –hukum termodinamika
9.3 Menggunakan hukum Termodinamika dalam perhitungan
Indikator
- Mengidentifikasi konsep gas ideal dan sifat-sifatnya
- Menganalisis dan merumkuskan keadaaan gas karena perubahan suhu, tekanan dan volume dalam bentuk persamaan matematis
- Merumuskan hukum Boyle guy Lussac tentang gas ideal dalam bentuk persamaan matematis
Materi pelajaran
a. Definisi gas ideal dan ciri–cirinya
b. Tekanan dan energi kinetik gas ideal
c. Keadaan mikroskopik sistem dan persamaan keadaan gas
Pengertian gas ideal
Gas ideal merupakan kumpulan dari partikel-partikel suatu zat yang jaraknya cukup jauh dibandingkan dengan ukuran partikelnya. Partikel-partikel itu selalu bergerak secara acak ke segala arah. Pada saat partikel-partikel gas ideal itu bertumbukan antar partikel atau dengan dinding akan terjadi tumbukan lenting sempurna sehingga tidak terjadi kehilangan energi.
Sifat gas ideal
1) Gas terdiri atas partikel-partikel dalam jumlah yang besar sekali, yang senantiasa bergerak dengan arah sembarang dan tersebar merata dalam ruang yang kecil.
2) Jarak antara partikel gas jauh lebih besar daripada ukuran partikel, sehingga ukuran partikel gas dapat diabaikan
3) Tumbukan antra partikel-partikel gas dan antra partikel dengan dinding temopatnya adalah elastis sempurna.
4) Hukum-hukum Newton tentang gerak berlaku.
2. Persamaan umum gas

dengan : P = tekanan gas (N/m2 atau Pa)
V = volume gas (m3)
T = suhu gas (K)
N = jumlah partikel
k = 1,38 . 10-23J/K
Dengan substitusi nilai N dan R maka persamaan dapat diubah menjadi :
N = N/No
T = suhu mutlak (oK)
R= k.No = 8,31/mol0K
n = jumlah partikel
V= volume (m3)
K= konstanta Bolztman = 1,38 10-23 J/oK
N0 = bilangan avogadro = 6,0231023 /mol
Pembahasan:
Diketauhi: m1= 1,2 kg
P1 = 2.105 Pa
T1= 27O + 273 = 300 K
T2 = 87O + 273 = 360 K
P2 = 3.105 Pa
Ditanya: m = ?
Pada setiap keadaan gas berlaku persamaan umum gas. PV = n R T. Substitusikan n = 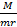 sehingga diperoleh: PV =
sehingga diperoleh: PV = ![clip_image117[1] clip_image117[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjDj4tHmK_8Ed7P915JMF52MZKkXWZ4X97lGqwOBmHloOGizxdcsGEMJjC4VeL8Ug4F0hRnVEh87LOAPkyj3RsQ898O_6Tz-P0mps5ZyuDLzYaSMs-jp9ZV-iFegFyAQVDC4uj3zUOxj2M/?imgmax=800) R T
R T
V, Mr dan R nilainya tetap sehingga berlaku hubungan 
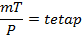



Berarti penambahan massanya:
m1 = m2 - m1 = 1,5 - 1,2 = 0,3 kg.
3. Tekanan Gas Ideal
Persamaan tekanan gas ideal dirumuskan sebagai berikut:

Dengan: N = bilangan avogadro = 6,023. 1023 /mol
M = massa partikel (kg)
v = kecepatan partikel (m/s)
V = volume gas (m3)
P = tekanan gas ideal (N/m2)
Olek karena Ek = ½.mv2, maka persamaan diatas dapat diubah menjadi:
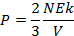
Ek = energi kinetik gas (J)
Termodinamika adalah cabang dari fisika yang mempelajari hukum-hukum dasar yang digunakan oleh kalor dan usaha. Jika volume suatu gas berubah, maka gas akan melakukan usaha luar. Usaha yang dilakukan oleh gas ketika volumenya berubah dari V1 menjadi V2 adalah :
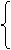


![clip_image134[1] clip_image134[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEh-TaiaVIxkixFTQulQfPTdsG5DsyoNyr5EqR5Tsc8aPx-RuIRa9s5rdnUscP5ECeIt9QyQMcbmIXLmWHzxqSiMQB7PhRWAkK-yzuinpiccahhTsC28qAmPA5Aj8KtpfCj2EUJYkiREqqs/?imgmax=800)
 W = F . Dh ® P =
W = F . Dh ® P = 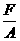
W = P . (A . Dh) F = P . A
W = P . DV
 W = usaha (joule)
W = usaha (joule)
 DV = selisih volume (m3)
DV = selisih volume (m3)
P = tekanan (N/m
2 = Pa)
Catatan :
¨ Untuk volume gas mengembang V2 > V1 ® DV > 0 ® W > 0
¨ Untuk volume gas menyusut V2 < V1 ® DV < 0 ® W < 0
¨ 1 atm = 105 Pa = 105 N/m2.
Gas dapat dipanaskan dengan 2 cara yaitu :
¨ Pada volume tetap
¨ Pada tekanan tetap
1. Pemanasan gas pada volume tetap
Kalor hanya digunakan untuk kenaikan suhu.



 DV = 0 ® W = 0 ® W = P . DV
DV = 0 ® W = 0 ® W = P . DV
W = P . 0
W = 0
Jumlah kalor yang diserap sebesar :
Qv = Cv . DT Cv = kapasitas kalor pad avolume tetap (J/0K)
= m . cv . DT cv = kalor jenis gas pada volume tetap (J/kg0K)
DT = selisih suhu (0K)
2. Pemanasan gas pada tekanan tetap
Kalor yang digunakan untuk : a. kenaikan suhu


 b. usaha luar
b. usaha luar

Q = DU + W ® W = P . DV
= DU + P (V
2 – V
1)
Qp = Cp . DT
= m . cp . DT
Cp = kapasitas kalor gas pada tekanan tetap (J/0K)
cp = Kalor jenis benda pada tekanan tetap (J/mol0K)
Hukum Termodinamika I
Energi tidak dapat diciptakan dan tidak dapat dimusnahkan. Jika suatu sistem menerima kalor, maka kalor tersebut akan digunakan untuk menambah energi dalam dan melakukan usaha luar.
Kemungkinan-kemungkinan yang terjadi dalam Termodinamika
1. Proses isotermis (suhu tetap)
Dalam proses ini tidak terjadi penambahan energi dalam. (DU = 0)
2.  Proses isokhoris (volume tetap) W = 0
Proses isokhoris (volume tetap) W = 0
Q = DU + W
3. Proses isobaris (tekanan tetap)
Q = DU + W
Q = DU + (P . DV)
4. Proses adiabatis
Dalam proses ini tidak terjadi penambahan/pengurangan kalor sehingga DQ = 0
 Q = DU + W
Q = DU + W
0 = DU + W
Catatan :
1. DU =  . n . R DT ® untuk gas monoatomik
. n . R DT ® untuk gas monoatomik
2. DU = 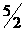 . n . R DT ® untuk gas diatomik
. n . R DT ® untuk gas diatomik
3. DQ = Å jika sistem menerima kalor
 DQ = – jika sistem mengeluarkan kalor
DQ = – jika sistem mengeluarkan kalor
4. W = Å jika sistem melakukan kerja
 W = – jika sistem menerima kerja
W = – jika sistem menerima kerja
5. DU = Å jika sistem mengalami penambahan energi
 DU = – jika sistem mengalami pengurangan energi
DU = – jika sistem mengalami pengurangan energi
Kemampuan gas untuk menyerap/melepaskan kalor.
1. Konsep kapasitas kalor gas
Jika sejumlah gas menerima kalor (Q) sehingga suhunya naik sebesar DT, maka besarnya kapasitas kalor gas adalah :
C =  = konstan
= konstan
C = 
2. Tekanan Laplace untuk gas monoatomik dan diatomik
- Untuk gas monoatomik :
Cv =  n . R dan Cp =
n . R dan Cp =  n . R
n . R
g =  = 1,67
= 1,67
- Untuk gas diatomik :
Cv = ![clip_image167[1] clip_image167[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhRE9SFI_1-eEDK-P66vaqpPv8FJbuIy5ioa2xy4YHW2JoqdWmK6UAqOPA40MJQGOBOmeQKOx6gdr_ktNRrpFe-B0mrtYQmtpnoLPH1V5HbJV3PDupYhgm_Iw9rzrtHRJAtuDv3dJUpucc/?imgmax=800) n . R dan Cp =
n . R dan Cp =  n . R
n . R
g = ![clip_image169[1] clip_image169[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjJrRvtXHHnlnLEvitzoTazKoesTWwbrBhjF9TZ3HhVbKphrRnL0acn_j4LtTEDFqu93tep0y_tuwL5DCpUyTYYeTbvA9kgsd8HRX7AWTYYpfXYjZNYtPo842TATSBMg5Wr2m2XezRNrKA/?imgmax=800) = 1,40
= 1,40
g = konstanta Laplace
Siklus Carnot
Yaitu : Siklus suatu mesin yang dapat bekerja secara reversibel (bolak-balik) tanpa kehilangan energi.
Siklus Carnot terdiri dari 4 proses yaitu :
1.

Isotermis
2. Adiabatis
3.
Isotermis
4. Adiabatis
Mula-mula gas dalam keadaan P . V. T
 Grafik a – b (proses isotermis)
Grafik a – b (proses isotermis)

 P a P1, V1 ® V1 > V ® P1 < P
P a P1, V1 ® V1 > V ® P1 < P
Grafik b – c (proses adiabatis)
 P1 b P2, V2, T1 ® V2 > V1 ® P2 < P1
P1 b P2, V2, T1 ® V2 > V1 ® P2 < P1
 P3 d Grafik c – d (proses isotermis)
P3 d Grafik c – d (proses isotermis)
 P2 c P3, V3, T1 ® V3 < V2 ® P3 > P2
P2 c P3, V3, T1 ® V3 < V2 ® P3 > P2
 Grafik d – a (proses adiabatis)
Grafik d – a (proses adiabatis)
V V3 V1 V2 Gas kembali ke posisi semula.
Suatu proses/siklus yang mengembalikan gas ke dalam keadaan awalnya, maka tidak ada penambahan energi dalam (DU = 0), maka usaha yang dilakukan sebesar.
DQ = DU + W
Q1 – Q2 = 0 + W ® W = Q1 – Q2
Keterangan :
Q1 = kalor yang diserap dari reservoir suhu tinggi T1
Q2 = kalor yang dibuang ke reservoir suhu rendah T2
 Skema mesin kalor
Skema mesin kalor
Reservoir suhu tinggi T1
¯
Q1
Mesin
Kalor
¯
Q2
Reservoir suhu rendah T2
Effisiensi Mesin Carnot
Yaitu : hasil bagi antara usaha yang dilakukan oleh suatu mesin W dengan kalor yang diserap Q1 (dalam satuan prosen)
h =  x 100%
x 100%
=  x 100%
x 100%

 karena
karena 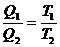
maka :
Keterangan :
h = effisiensi mesin (%)
T2 = suhu rendah dari reservoir (0K)
T1 = suhu tinggi dari reservoir (0K)
Q1 = kalor yang diserap dari T1 (joule)
Q2 = kalor yang dilepas dari T2 (joule)
Karena dalam kenyataan sehari-hari tidak ada suatu mesin yang bekerja secara ideal maka nilai h < 100%.
Contoh Soal :
1. Sejumlah gas didinginkan hingga volumenya berkurang dari 0,4 ℓ menjadi 2,5 ℓ pada tekanan konstan 1 x 105 Pa. Hitung usaha luar yang dilakukan oleh gas?
2. Sebuah mesin carnot yang menggunakan reservoir suhu tinggi 8000K mempunyai efisiensi 40%. Agar effisiensinya menjadi 50%, berapakah suhu reservoir tinggi harus dinaikkan?
Soal-Soal Latihan
Jawablah pertanyaan-pertanyaan di bawah ini dengan singkat dan tepat!
1. Hitung berapa usaha yang dilakukan gas agar volumenya bertambah dari 4 liter menjadi 7 liter pada tekanan tetap 1 atm!
2. Dua mol gas argon memuai secara isothermal pada suhu 300 K dari volume
0,03 m3 ke volume akhir 0,2 m3. Bila tekanan awal gas 8,31 . 107 Pa. Tentukan :
a. Tekanan akhir gas
b. Usaha yang dilakukan gas bila R = 8,31 j / mol k
3. Di dalam tangki tertutup terdapat 0,02 mol gas monoatomik dengan sehu 270C. Berapa kalor yang diperlukan agar suhu gas naik menjadi 1270C, jika tetapan gas R = 8,31 J mol-1 K-1?
4. Gas ideal monoatomik mula-mula volumenya 3,5 m3. Tekanannya 105 N/m2 dan suhu 2700K. Gas ini mengalami tekanan tetap sampai volumenya 10 m3.
a. Tentukan suhu gas akhir proses!
b. Berapa usaha yang dilakukan gas?
5. Suatu mol gas helium memuai isokhorik dari temperature 600C ke temperature 270C. Bila tekanan awal gas = 9,31 . 107 Pa. Tentukan:
a. Tekanan akhir gas
b. Adakah kerja yang dilakukan gas
Pilihlah salah satu jawaban yang paling tepat dengan cara memberi tanda silang (x) pada huruf a, b, c, d atau e!
1. Hukum I Termodinamika menyatakan bahwa ....
a. Energi adalah kekal d. Suhu adalah tetap
b. Sistem tidak mendapat usaha dari luar e. Energi dalam adalah kekal
c. Kalor tidak dapat masuk ke dalam dan keluar dari suatu sistem
2. Pada diagaram P = V ....
a. Dapat digambarkan proses-proses isobarik dan isokhorik saja
b. Dapat digambarkan proses macam apa saja
c. Dapat digambarkan proses isobarik, isokhorik, isothermik, dan adiabatik saja.
d. Dapat digambarkan proses kuasistatik saja
e. Hanya dapat digambarkan proses-proses dapat balik dan tidak dapat balik
3. Grafik p – v berikut merupakan siklus mesin kalor. Tentukan usaha yang dilakukannya ....
a.  4 . 10-5 j
4 . 10-5 j
b. 5 . 105 j
c. 5 . 10-6 j
d. 6 . 10-5 j
e. 6 . 105 j
4. 2,5 m3 gas neon bersuhu 520C dipanaskan secara isobarik sampai 910C. Jika tekanan gas neon adalah 4,0 x 105 N/m2. Tentukan usaha yang dilakukan gas neon
a. 1,1 . 10-5 j
b. 1,2 . 105 j
c. 1,3 . 105 j
d. 1,2 . 10-5 j
e. 1,2 . 106 j
5. Suatu gas memuai dari 7,0 L menjadi 8,2 L pada tekanan tetap 2,5 bar
(1 bar = 105 Pa) selama pemuaian 500 j ditambahkan. Tentukan perubahan energi dalam ....
a. 2 j d. 2000 j
b. 20 j e. 20000 j
c. 200 j
6. Dalam suatu siklus mesin carnot, suhu reservoir (yang mensuplai kalor) adalah 1270C dan suhu kondensor (yang menampung kalor yang dibuang mesin) adalah 270C. Kalor yang diambil mesin per siklus adalah 60 j. Hitung kalor yang dibuang
a. 45 j d. 55 j
b. 4,5 j e. 5,5 j
c. 450 j
7. Dari soal no. 6 Hitung usaha yang dilakukan mesin ....
a. 1500 j d. 15 j
b. 150 j e. 1,5 j
c. 15000 j
8. Dari soal no. 6 Hitung efisien mesin ....
a. 100% d. 25%
b. 75% e. 10%
c. 50%
9. Suatu mesin carnot bekerja dalam reservoir suhu tinggi 9000K mempunyai efesiensi 30%. Berarti reservoir suhu rendah sama dengan ....
a. 6000C d. 9000C
b. 7000C e. 6270C
c. 8000C
10. Suatu mesin carnot beroperasi dengan reservoir yang temperaturnya T1 dan T2
(T1 > T2). Efesiensi carnot tersebut ....
a.  d.
d. 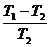
b.  e.
e. 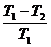
c. 
11. Suhu tinggi reservoir mesin carnot 600 K dan efesiensi 50% agar efesiensi mesin carnot itu menjadi 70%. Berapa suhu tinggi reservoir mesin carnot ....
a. 500 K d. 2000 K
b. 1500 K e. 1000 K
c. 375 K
12. Untuk memampatkan 2 mol gas monotermik dilakukan usaha sebesar 3,5 . 104 J, sehingga suhu untuk gas itu menjadi 2 kali suhu awal. Berapa suhu awal gas tersebut .... (R = 8,31 j/mol K)
a. 1430,9 K d. 1403,9 K
b. 1340,9 K e. 1433,9 K
c. 1243,9 K
13. Dalam membuat es, sebuah motor mengoperasikan mesin pendingin. Kalor Q2 diambil dari sebuah ruang pendingin yang mengandung sejumlah air pada 00C dan kalor Q1 di buang ke udara sekitarnya pada 150C anggap mesin pendingin menaiki koefisien performasi 20% dari koefisien performasi mesin pendingin ideal. Hitung usaha yang dilakukan motor untuk membuat 1 kg es (kalor laten lebur es
3,4 . 105 j/kg) ....
a. 3,4 . 105 j d. 8,3 . 105 j
b. 2 . 104 j e. 9,3 . 104 j
c. 7,5 . 105 j
14. Analog soal no. 13. Berapa lama diperlukan untuk membuat 1 kg es jika daya motor adalah 50 W ....
a. 31 menit d. 41 menit
b. 30 menit e. 45 menit
c. 60 menit
15. Suatu gas volumenya 1 m3 perlahan-lahan dipanaskan. Pada tekanan tetap, hitung volumenya menjadi 4 m3. Jika usaha luar gas tersebut 3 x 105 J. Hitung tekanan luas ....
a. 1 . 104 Nm-2 d. 2 . 105 Nm-2
b. 1 . 105 Nm-2 e. 3 . 104 Nm-2
c. 2 . 104 Nm-2
16.  Perhatikan gambar di samping. Bila efisiensi mesin = b, maka nilai T2 adalah
Perhatikan gambar di samping. Bila efisiensi mesin = b, maka nilai T2 adalah
a. T2 = a (1 + b) k
b. T2 = a (1 – b) k
c. T2 = 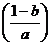 k
k
d. T2 = 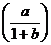 k
k
e. T2 =  k
k
17. Energi kalor tidak seluruhnya dapat diubah menjadi energi mekanik atau usaha, sebagian akan terbuang. Pertanyaan ini dikenal sebagai ....
a. Hukum I Termodinamika
b. Hukum kekekalan energi
c. Hukum Joule
d. Hukum II Termodinamika
e. Hukum Newton
18.  Suatu gas wadah silinder tertutup mengalami proses seperti pada gambar. Berapa usaha yang dilakukan oleh gas untuk poros AB ....
Suatu gas wadah silinder tertutup mengalami proses seperti pada gambar. Berapa usaha yang dilakukan oleh gas untuk poros AB ....
a. 0
b. 48.750 j
c. 2.625 j
d. 75.000 j
e. 123.750 j
19. Analog soal no. 18. Berapa usaha yang dilakukan oleh gas untuk proses BC ....
a. 123.750 j d. 75.000 j
b. 48.750 j e. 0
c. 26,25 j
20. Analog soal no. 18. Berapa usaha yang dilakukan oleh gas untuk proses CA ....
a. 48750 j d. 75.000 j
b. 123.750 j e. 0
c. 26,25 j
21. Hitung usaha yang dilakukan gas agar volumenya bertambah dari 10 liter menjadi 20 liter pada tekanan tetap 1 atm ....
a. 10,1 . 102 j
b. 1,01 . 102 j
c. 10,1 . 103 j
d. 1,01 . 103 j
e. 101 . 102 j
22. 200 j usaha yang dilakukan pada sebuah sistem dan 70,0 kalori dikeluarkan dari sistem. Berdasarkan Hukum I Termodinamika, berapa usaha yang dilakukan sistem ....
a. –70 j d. 200 j
b. 70 j e. 4.20 j
c. –200 j
23. Analog soal no. 22. Berapa kalor yang keluar dari sistem ....
a. 200 j d. – 249 j
b. –200 j e. – 70,0 j
c. 294 j
24. Analog soal no. 22. Berapa perubahan energi dalam ....
a. 94 j d. 294 j
b. – 94 j e. 200 j
c. – 294 j
25. Jika sebuah mesin carnot menggunakan reservoir dengan suhu tinggi 6270C dan mempunyai efisiensi 50%, berapa suhu yang rendah ....
a. 450 d. 750
b. 550 e. 850
c. 650









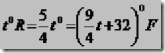













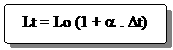
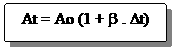






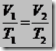
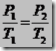


















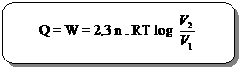




 Skema mesin kalor
Skema mesin kalor
 karena
karena  4 . 10-5 j
4 . 10-5 j Perhatikan gambar di samping. Bila efisiensi mesin = b, maka nilai T2 adalah
Perhatikan gambar di samping. Bila efisiensi mesin = b, maka nilai T2 adalah  Suatu gas wadah silinder tertutup mengalami proses seperti pada gambar. Berapa usaha yang dilakukan oleh gas untuk poros AB ....
Suatu gas wadah silinder tertutup mengalami proses seperti pada gambar. Berapa usaha yang dilakukan oleh gas untuk poros AB ....